Ikatan Kimia
Simbol Lewis dari suatu unsur terdiri dari simbol unsur tersebut dan satu titik untuk setiap satu elektron valensi yang dimilikinya. Sebagai contoh, perhatikan simbol Lewis untuk unsur-unsur berikut.

Materi Ikatan Kimia: Simbol titik-elektron Lewis untuk unsur-unsur golongan utama periode 2 dan 3
(Sumber: Silberberg, Martin S. 2009. Chemistry: The Molecular Nature of Matter and Change (5th edition). New York: McGraw Hill)
Ikatan ionik (ikatan elektrovalen): “transfer elektron”
Atom logam (energi ionisasi rendah) cenderung melepaskan elektronnya, lalu diterima oleh atom nonlogam (afinitas elektron besar). Dari proses transfer elektron dari atom logam ke atom nonlogam ini akan terbentuk ion positif dan ion negatif dengan konfigurasi elektron gas mulia yang saling tarik menarik dengan gaya elektrostatis yang disebut ikatan ionik. Sebagai contoh, dalam pembentukan senyawa ionik NaCl terjadi transfer elektron dari atom Na ke atom Cl.Ikatan kovalen: “sharing elektron”
Atom-atom nonlogam cenderung tidak ingin melepaskan elektronnya (energi ionisasi tinggi) dan ingin menarik elektron-elektron dari atom lainnya (afinitas elektron besar) sehingga terdapat satu atau lebih pasangan elektron yang dipakai untuk berbagi bersama. Ikatan kimia yang terbentuk dari sharing elektron terlokalisasi antara atom ini disebut ikatan kovalen. Sebagai contoh, 2 atom H berikatan kovalen membentuk molekul H2 dan 2 atom Cl berikatan kovalen membentuk molekul Cl2.
Struktur Lewis untuk senyawa kovalen dapat digambarkan dengan setiap pasangan elektron ikatan (PEI) digambarkan sebagai satu garis dan pasangan elektron bebas (PEB) digambarkan sebagai titik-titik. Berikut struktur Lewis untuk beberapa senyawa kovalen.

Ikatan kovalen dengan berbagi satu pasangan elektron disebut sebagai ikatan kovalen tunggal (ikatan tunggal). Ikatan kovalen dengan berbagi dua pasangan elektron disebut ikatan rangkap dua, contohnya CO2. Ikatan kovalen dengan berbagi tiga pasangan elektron disebut ikatan rangkap tiga, contohnya N2.

Kepolaran Ikatan, Elektronegativitas, dan Momen Dipol
Ikatan kimia di mana elektron-elektron digunakan bersama secara setara dan merata, seperti pada Cl2 dan N2, disebut sebagai ikatan kovalen nonpolar. Ikatan di mana salah satu atom memiliki daya tarik elektron (elektronegativitas) yang lebih tinggi terhadap elektron-elektron ikatan dibanding atom lainnya, sehingga terjadi pembentukan dipol (pemisahan muatan negatif dan muatan positif), seperti pada HF, disebut sebagai ikatan kovalen polar.Ukuran kepolaran dinyatakan dengan besaran yang disebut momen dipol (μ). Semakin besar momen dipol, semakin besar kepolarannya. Satuan momen dipol adalah debye (D), di mana 1 D = 3,34×10−30 Cm. Jika dua muatan berlawanan dengan besar muatan sama Q+ dan Q− terpisah dengan jarak r, maka momen dipolnya adalah hasil kali Q dan r:
μ = Qr
Contoh soal Ikatan Kimia
Panjang ikatan dalam molekul HCl adalah 1,27 Å. Hitunglah momen dipol (dalam debye) bila muatan pada atom H dan Cl masing-masing adalah +1 dan −1.Jawab:
Muatan pada atom H dan Cl adalah sebesar muatan e−.
r = 1,27 Å = 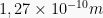
Pengecualian Aturan Oktet

Ikatan Kovalen Koordinasi
Ikatan kovalen koordinasi (ikatan dativ) adalah ikatan kovalen di mana salah satu atomnya mendonasikan pasangan elektron yang dimilikinya. Pada ikatan kovalen koordinasi, pasangan elektron ikatannya hanya berasal dari satu atom, bukan dari kontribusi bersama kedua atom yang berikatan. Contoh:
Ikatan logam: “lautan elektron”
Atom-atom logam cenderung mudah melepaskan elektronnya (energi ionisasi rendah) dan susah menangkap elektron (afinitas elektron kecil) sehingga elektron-elektron valensi terdelokalisasi dan tersebar merata menjadi lautan elektron di antara kation-kation logam. Elektron-elektron “mengalir” di antara dan sekeliling kation logam dan mengikatkan kation-kation logam tersebut.
Ilustrasi 3 jenis ikatan kimia: ionik, kovalen, dan logam
(Sumber: Silberberg, Martin S. 2009. Chemistry: The Molecular Nature of Matter and Change (5th edition). New York: McGraw Hill)






0 comments:
Post a Comment